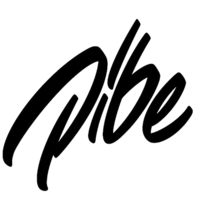Enthalpie


Enthalpie
Einleitung
In diesem aiMOOC beschäftigen wir uns mit einem zentralen Konzept der Thermodynamik und der Chemie: der Enthalpie. Die Enthalpie ist eine thermodynamische Zustandsgröße, die für viele Prozesse in der Chemie und der Physik von grundlegender Bedeutung ist. Sie beschreibt die Gesamtenergie eines Systems unter konstantem Druck und spielt eine entscheidende Rolle beim Verständnis von Energieumwandlungen und chemischen Reaktionen. Wir werden die Konzepte rund um die Enthalpie ausführlich erkunden, von ihrer Definition und Berechnung bis hin zu ihrer Anwendung in der Praxis. Dabei werden interaktive Elemente genutzt, um das Gelernte zu vertiefen und praktisch anzuwenden.
Was ist Enthalpie?
Die Enthalpie (Symbol H) ist eine Zustandsgröße, die die Gesamtenergie eines Systems unter konstantem Druck beschreibt. Sie setzt sich zusammen aus der innere Energie des Systems (U) und dem Produkt aus dem Druck (P) und dem Volumen (V) des Systems:
H=U+PV
Diese Größe ist besonders wichtig für die Beschreibung von Energieübertragungen in Form von Wärme und Arbeit bei chemischen Reaktionen und physikalischen Prozessen, die bei konstantem Druck ablaufen.
Bedeutung der Enthalpie in der Chemie
Die Enthalpie ermöglicht es uns, die Energieänderungen zu berechnen, die während chemischer Reaktionen auftreten. Wenn eine Reaktion bei konstantem Druck abläuft und die Enthalpie des Systems sich ändert, wird Energie in Form von Wärme entweder vom System aufgenommen (endotherme Reaktion) oder an die Umgebung abgegeben (exotherme Reaktion). Diese Energieänderungen sind entscheidend für das Verständnis der Triebkraft chemischer Reaktionen und der Energieeffizienz von chemischen Prozessen.
Berechnung der Enthalpieänderung
Die Änderung der Enthalpie bei einer chemischen Reaktion wird oft durch die Differenz der Enthalpien der Produkte und der Edukte berechnet. Recherchiere nach den Formeln.
Interaktive Aufgaben
Quiz: Teste Dein Wissen
Was ist die Enthalpie? (Eine thermodynamische Zustandsgröße, die die Gesamtenergie eines Systems unter konstantem Druck beschreibt) (!Die Energie, die in chemischen Bindungen gespeichert ist) (!Die Wärmemenge, die für eine Zustandsänderung benötigt wird) (!Der Druck, der in einem geschlossenen System herrscht)
Welche Aussage über die Enthalpie ist falsch? (!Die Enthalpie eines isolierten Systems bleibt immer konstant) (Energie kann in Form von Wärme zwischen dem System und seiner Umgebung ausgetauscht werden, wenn die Enthalpie sich ändert) (Enthalpieänderungen sind für das Verständnis von chemischen Reaktionen wichtig) (Die Enthalpie wird durch die innere Energie und das Produkt aus Druck und Volumen des Systems beschrieben)
Memory
| Enthalpie (\(H\)) | Gesamtenergie eines Systems unter konstantem Druck |
| Endotherme Reaktion | Positive \(\Delta H\) |
| Exotherme Reaktion | Negative \(\Delta H\) |
| \(H = U + PV\) | Formel für Enthalpie |
| Energieübertragung in Reaktionen | Durch \(\Delta H\) beschrieben |
Kreuzworträtsel
| enthalpie | Was ist eine thermodynamische Zustandsgröße, die die Gesamtenergie eines Systems beschreibt? |
| endotherm | Wie nennt man Reaktionen, die Energie aufnehmen? |
| exotherm | Wie nennt man Reaktionen, die Energie abgeben? |
| energie | Was wird bei chemischen Reaktionen umgewandelt? |
| deltaH | Symbol für Enthalpieänderung |
| druck | P in der Enthalpieformel steht für? |
| volumen | V in der Enthalpieformel steht für? |
LearningApps
Lückentext
Offene Aufgaben
Leicht
- Erstelle ein Diagramm, das die Enthalpieänderungen bei endothermen und exothermen Reaktionen veranschaulicht.
- Beschreibe in eigenen Worten, was Enthalpie ist und warum sie wichtig für chemische Reaktionen ist.
- Recherchiere ein Beispiel für eine endotherme und eine exotherme Reaktion und präsentiere deine Ergebnisse.
Standard
- Führe ein Experiment durch, um eine endotherme und eine exotherme Reaktion zu demonstrieren. Dokumentiere die Energieänderungen.
- Berechne die Enthalpieänderung für eine einfache chemische Reaktion anhand gegebener Daten.
- Erkläre den Unterschied zwischen innerer Energie und Enthalpie mit Beispielen.
Schwer
- Untersuche die Auswirkungen von Enthalpieänderungen auf das chemische Gleichgewicht in einer Reaktion.
- Entwickle ein Lehrvideo, das das Konzept der Enthalpie und seine Bedeutung in der Chemie erklärt.
- Analysiere die Enthalpieänderungen in einem komplexen chemischen Prozess, z.B. in der industriellen Herstellung.


Lernkontrolle
- Beschreibe, wie die Enthalpieänderung die Richtung einer chemischen Reaktion beeinflussen kann.
- Erkläre, warum die Enthalpie eine Zustandsgröße ist und welche Konsequenzen dies für die Chemie hat.
- Entwickle ein Konzept für eine energieeffiziente Reaktion unter Berücksichtigung der Enthalpieänderungen.
- Vergleiche die Energieumwandlungen bei endothermen und exothermen Reaktionen anhand konkreter Beispiele.
OERs zum Thema
Links
Teilen - Diskussion - Bewerten
Schulfach+


aiMOOCs



aiMOOC Projekte


THE MONKEY DANCE
|
|
|

Sponsoren, Förderer, Kooperationspartner

Children for a better world >> Förderung der AI Fair-Image Challenge
Fair-Image wird von CHILDREN JUGEND HILFT! gefördert und ist mit der deutschlandweiten AI Fair-Image Challenge SIEGERPROJEKT 2025. Alle Infos zur Challenge hier >>. Infos zum Camp25 gibt es hier. Wenn auch Ihr Euch ehrenamtlich engagiert und noch finanzielle Unterstützung für Eurer Projekt braucht, dann stellt gerne einen Antrag bei JUGEND HILFT.